CALOR
 Cuando dos cuerpos a distintas temperaturas se ponen en contacto, terminan igualando sus temperaturas. Entonces se dice que se ha alcanzado el equilibrio térmico.
Cuando dos cuerpos a distintas temperaturas se ponen en contacto, terminan igualando sus temperaturas. Entonces se dice que se ha alcanzado el equilibrio térmico.
Cuando dos sistemas entran en contacto, las partículas con mayor energía cinética transfieren, mediante choques, parte de su energía a las restantes partículas, de manera que al final la energía cinética media de todo el conjunto es la misma.
Cuando dos sistemas en desequilibrio térmico entran en contacto, el de mayor temperatura transfiere energía térmica al de menor temperatura hasta conseguir el equilibrio térmico.
El calor es la transferencia de energía desde un cuerpo que se encuentra a mayor temperatura hasta otro de menor temperatura. Cuando ambos cuerpos igualan sus temperaturas se detiene la transmisión de energía.
El calor siempre se transfiere desde el cuerpo de mayor temperatura al de menor temperatura, independientemente de sus tamaños relativos.
Unidades de medida del calor
El calor se mide en unidades de energía. Por tanto, en el Sistema Internacional su unidad es el julio (J). Sin embargo, la unidad tradicional para medir el calor es la caloria (cal). La equivalencia es:
1 cal = 4,184 J ó 1 J = 0,24 cal
La transmisión de calor siempre ocurre desde el cuerpo más caliente al más frío. Se puede dar por tres mecanismos: Conducción, convención y radiación:
Conducción:
El proceso por el que se transmite calor de un punto a otro de un sólido se llama Conducción.
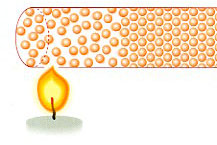
En la conducción se transmite energía térmica, pero no materia. Los átomos del extremo que se calienta, empiezan a moverse más rápido y chocan con los átomos vecinos transmitiendo la energía térmica.
Las sustancias tienen distinta conductividad térmica, existiendo materiales conductores térmicos y aislantes térmicos.
Conductores térmicos: Son aquéllas sustancias que transmiten rápidamente la energía térmica de un punto a otro. Por ejemplo, los metales.
Aislantes térmicos: Son aquéllas sustancias que transmiten lentamente la energía térmica de un punto a otro. Ejemplos: Vidrio, hielo, ladrillo rojo, madera, corcho, etc. Suelen ser materiales porosos o fibrosos que contienen aire en su interior.

Convección:
La convección es el proceso por el que se transfiere energía térmica de un punto a otro de un fluido (líquido o gas) por el movimiento del propio fluido.

Al calentar, por ejemplo, agua en un recipiente, la parte del fondo se calienta antes, se hace menos densa y sube, bajando el agua de la superficie que está más fría y así se genera un proceso cíclico.
En la convección se transmite energía térmica mediante el transporte de materia.
Radiación:
La radiación es el proceso por el que los cuerpos emiten energía que puede propagarse por el vacío.
La energía que los cuerpos emiten por este proceso se llama Energía radiante. Por ejemplo, la Tierra recibe energía radiante procedente del Sol, gracias a la cual la temperatura del planeta resulta idónea para la vida.
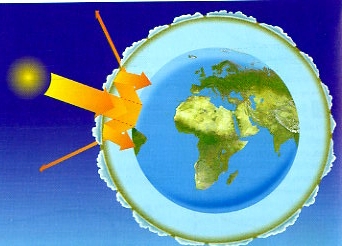
Todos los cuerpos radian energía en función de su temperatura. Cuanto mayor sea la temperatura, mayor será la energía de la radiación que emiten.

Diferencias entre calor y temperatura:
Todos sabemos que cuando calentamos un objeto su temperatura aumenta. A menudo pensamos que calor y temperatura son lo mismo. Sin embargo, esto no es así. El calor y la temperatura están relacionadas entre sí, pero son conceptos diferentes.
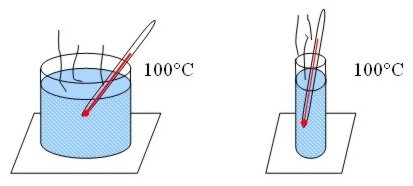
Como ya dijimos, el calor es la energía total del movimiento molecular en un cuerpo, mientras que la temperatura es la medida de dicha energía. El calor depende de la velocidad de las partículas, de su número, de su tamaño y de su tipo. La temperatura no depende del tamaño, ni del número ni del tipo.
Por ejemplo, si hacemos hervir agua en dos recipientes de diferente tamaño, la temperatura alcanzada es la misma para los dos, 100° C, pero el que tiene más agua posee mayor cantidad de calor.
El calor es lo que hace que la temperatura aumente o disminuya. Si añadimos calor, la temperatura aumenta. Si quitamos calor, la temperatura disminuye.
La temperatura no es energía sino una medida de ella; sin embargo, el calor sí es energía.
Calor Latente:
El cambio de temperatura de una sustancia conlleva una serie de cambios físicos. Casi todas las sustancias aumentan de volumen al calentarse y se contraen al enfriarse. El comportamiento del agua entre 0 y 4 °C constituye una importante excepción a esta regla. Se denomina fase de una sustancia a su estado, que puede ser sólido, líquido o gaseoso. Los cambios de fase en sustancias puras tienen lugar a temperaturas y presiones definidas. El paso de sólido a gas se denomina sublimación, de sólido a líquido fusión, y de líquido a vapor vaporización. Si la presión es constante, estos procesos tienen lugar a una temperatura constante. La cantidad de calor necesaria para producir un cambio de fase se llama calor latente; existen calores latentes de sublimación, fusión y vaporización. Si se hierve agua en un recipiente abierto a la presión de 1 atmósfera, la temperatura no aumenta por encima de los 100 °C por mucho calor que se suministre. El calor que se absorbe sin cambiar la temperatura del agua es el calor latente; no se pierde, sino que se emplea en transformar el agua en vapor y se almacena como energía en el vapor. Cuando el vapor se condensa para formar agua, esta energía vuelve a liberarse. Del mismo modo, si se calienta una mezcla de hielo y agua, su temperatura no cambia hasta que se funde todo el hielo. El calor latente absorbido se emplea para vencer las fuerzas que mantienen unidas las partículas de hielo, y se almacena como energía en el agua. Para fundir 1 kg de hielo se necesitan 19.000 julios, y para convertir 1 kg de agua en vapor a 100 °C, hacen falta 129.000 julios


No hay comentarios:
Publicar un comentario